Restaurer la vision grâce à une nouvelle interface cerveau-machine : la thérapie sonogénétique
Restaurer la vision grâce à une thérapie associant génétique et ultrasons ? Tel est l’objectif poursuivi par une équipe internationale dirigée par les directeurs de recherche Inserm Mickael Tanter et Serge Picaud, associant respectivement le laboratoire Physique pour la médecine (ESPCI Paris/PSL Université/Inserm/CNRS) et l’Institut de la vision (Sorbonne Université/Inserm/CNRS) à Paris en partenariat avec l’Institut d’ophtalmologie moléculaire et clinique de Bâle. Dans une nouvelle étude, ils ont apporté la preuve de concept de cette thérapie dite « sonogénétique » chez l’animal. Celle-ci consiste à modifier génétiquement certains neurones afin de pouvoir les activer à distance par des ultrasons. Les résultats montrent que, lorsqu’elle est utilisée sur les neurones de rongeurs, la sonogénétique permet d’induire une réponse comportementale associée à une perception lumineuse. Cette découverte permet d’envisager à plus long terme une application chez les personnes aveugles atteintes d’atrophie du nerf optique. L’étude est publiée dans Nature Nanotechnology.
-
Serge Picaud, directeur de recherche Inserm
-
Mickael Tanter, directeur de recherche Inserm
-
Service de presse de l'Inserm
La thérapie sonogénétique consiste à modifier génétiquement certains neurones afin de pouvoir les activer à distance par des ultrasons. Cette technologie avait préalablement été testée en culture et les premiers tests in vivo n’avaient pas permis de prendre conscience de son potentiel thérapeutique lié à sa très haute résolution spatiotemporelle. La modification génétique en question consiste à introduire le code génétique d’un canal ionique mécanosensible dans les cellules. Les neurones qui expriment ce canal peuvent alors être activés à distance par des ultrasons de faible intensité appliqués à la surface du cerveau sans nécessiter de contact (cf. schéma ci-dessous).
La thérapie sonogénétique consiste à modifier génétiquement certains neurones afin de pouvoir les activer à distance par des ultrasons. Cette technologie avait préalablement été testée en culture et les premiers tests in vivo n’avaient pas permis de prendre conscience de son potentiel thérapeutique lié à sa très haute résolution spatiotemporelle. La modification génétique en question consiste à introduire le code génétique d’un canal ionique mécanosensible dans les cellules. Les neurones qui expriment ce canal peuvent alors être activés à distance par des ultrasons de faible intensité appliqués à la surface du cerveau sans nécessiter de contact (cf. schéma ci-dessous).
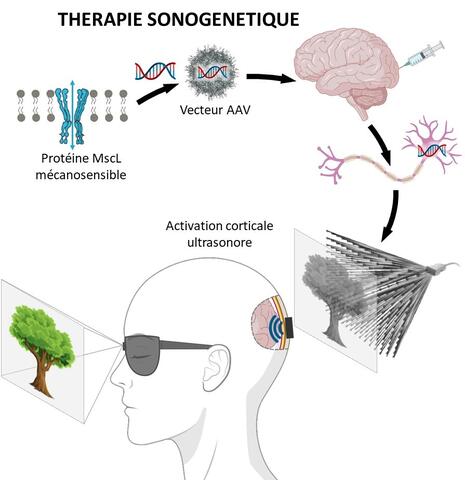
Les ondes ultrasonores peuvent en effet accéder à des tissus en profondeur, comme dans le cortex visuel, même depuis la surface de la dure-mère[1] qui entoure le cerveau, et cibler des zones très précises. Ce sont ces ondes qui sont à la base des technologies d’échographie ou d’imagerie du cerveau à haute résolution. Dans le cas présent, elles permettent une activation très sélective, puisque seuls les neurones porteurs du canal mécanosensible et ciblés par le faisceau ultrasonore sont stimulés.
Dans une récente étude, une équipe de chercheurs et chercheuses menée par les directeurs de recherche Inserm Mickael Tanter et Serge Picaud a testé l’efficacité de cette thérapie sonogénétique chez l’animal. L’objectif de cette recherche est d’apporter une solution pour redonner la vue aux patients qui ont perdu la connexion entre leurs yeux et leur cerveau au cours de pathologies comme le glaucome, la rétinopathie diabétique, ou les neuropathies optiques héréditaires ou alimentaires.
Leurs résultats indiquent que la stimulation sonogénétique du cortex visuel permet d’induire une réponse comportementale associée à une perception lumineuse. L’animal apprend un comportement associatif dans lequel il cherche à boire dès qu’il perçoit la lumière. La stimulation ultrasonore de son cortex visuel induit le même réflexe uniquement si les neurones du cortex expriment le canal mécanosensible. Le comportement de l’animal suggère que la stimulation sonogénétique de son cortex a induit la perception lumineuse à l’origine du réflexe comportemental.
L’étude a montré que la thérapie fonctionne sur différents types de neurones, qu’ils soient dans la rétine ou dans le cortex visuel des rongeurs, démontrant ainsi le caractère universel de cette approche.
En convertissant les images de notre environnement sous forme d’une onde ultrasonore codée pour stimuler directement le cortex visuel, et ce à des cadences de plusieurs dizaines d’images à la seconde, la thérapie sonogénétique apparaît comme un réel espoir pour restaurer la vue des patients ayant perdu la fonction du nerf optique.
Plus généralement, cette approche de stimulation sonogénétique offre une technologie innovante pour interroger le fonctionnement du cerveau. À la différence des prothèses ou des stimulateurs neuronaux actuels, son fonctionnement « sans contact » et sélectif d’un type cellulaire représente une innovation majeure par rapport aux dispositifs avec électrodes.
« Cette thérapie sonogénétique pour restaurer, à terme, la vision de personnes aveugles illustre la puissance d’un projet pluridisciplinaire et d’une belle aventure humaine entre un biologiste de la rétine comme Serge Picaud, et moi-même, un physicien des ondes pour la médecine », déclare Mickael Tanter, directeur de recherche Inserm au laboratoire Physique pour la médecine de Paris (ESPCI Paris/PSL Université/Inserm/CNRS).
« Le développement d’un essai clinique de thérapie sonogénétique demande encore de passer par de nombreuses étapes pour valider son efficacité et sa sécurité. Si les résultats se confirment, cette thérapie pourrait réussir à restaurer la vue des patients de manière stable et en toute sécurité », conclut Serge Picaud, directeur de recherche Inserm et de l’Institut de la vision (Sorbonne Université/Inserm/CNRS).
[1] Couche la plus externe des méninges protégeant le cerveau.
Sources :
Ectopic expression of a mechanosensitive channel confers spatiotemporal resolution to ultrasound stimulations of neurons for visual restoration, Sara Cadoni, Charlie Demené, Ignacio Alcala, Matthieu Provansal, Diep Nguyen, Dasha Nelidova, Guillaume Labernede, Jules Lubetzki, Ruben Goulet, Emma Burban, Julie Dégardin, Manuel Simonutti, Gregory Gauvain, Fabrice Arcizet, Olivier Marre, Deniz Dalkara, Botond Roska, José Alain Sahel, Mickael Tanter, Serge Picaud, Nature Nanotechnology, 03 avril 2023
